肝癌是中国高发恶行肿瘤。由于其广泛的肿瘤异质性,最新的靶向联合免疫治疗的方案仅对20~30%的患者有效,并且缺乏指导精准用药的药敏分子分型。因此亟需研究可以指导肝癌精准用药的分子分型和揭示新的耐药靶点。
北京大学第一医院、北京大学-云南白药国际医学研究中心、北京大学国际癌症研究院张宁教授团队,近年来一直聚焦于肝癌异质性探究,通过一系列前期工作揭示了肝癌的基因组异质性(Gastroenterology, 2016)、表型异质性(Cancer Cell, 2019)、单细胞拷贝数异质性(Gastroenterology, 2022),和免疫微环境异质性的特征, 提出并初步验证了中心粒细胞可用于肝癌免疫治疗的假说(Nature,2022)。
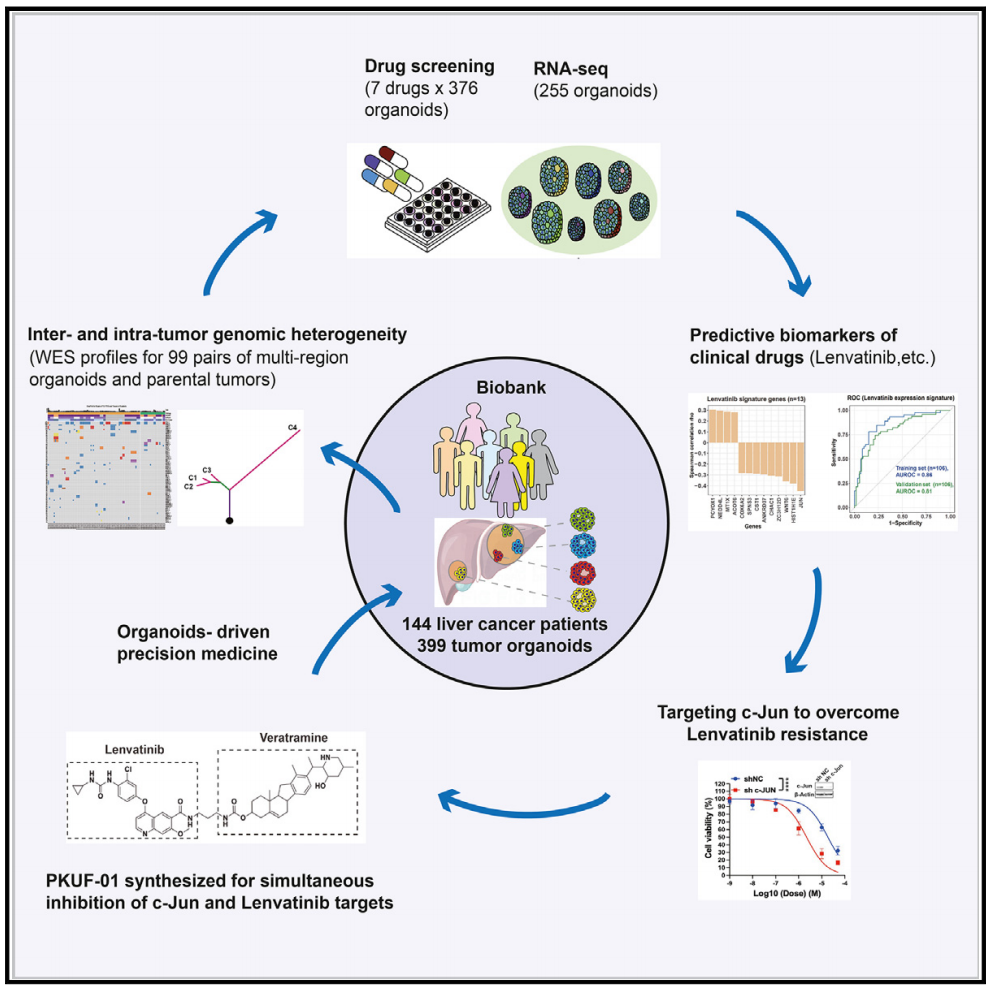
在此基础上,2024年4月8日,张宁团队联合北京大学肿瘤医院吴健民团队、北京大学第一医院杨兴团队,通过与河南省肿瘤医院张建功团队合作,在Cancer Cell发表了题为:Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer的研究论文。该研究基于中国肝癌患者的手术样本,建立了144位肝癌患者的类器官生物库,包括399个肿瘤类器官品系。通过对组织和类器官的外显子及转录组测序,揭示了类器官的基因和药敏异质性特征。通过对肝癌靶向药的大规模药敏测试,结合转录组数据和机器学习模型,揭示了可以指导用药的肝癌药敏分子分型。进一步机制研究,联合团队发现c-Jun 高表达是造成肝癌耐药的一个重要因素,揭示了耐药机制,并在此基础上形成联合用药新方案。张宁教授牵头的跨学科攻关团队基于大规模类器官研究,结合多组学分析、机器学习技术、以及药理学研究,建立了针对临床药物的药敏分子分型,为肝癌的实现精准诊疗提供了重要依据。

1)建立高质量类器官生物库
团队对肝癌患者的手术标本多点取样,成功建立了涵盖144位患者,399个肿瘤位点的肝癌类器官生物库。在本团队建立的类器官生物库中,肝细胞癌病例占比87%,肝内胆管癌病例占比12%,混合型肝癌病例占比1%,与肝癌流行病学是一致的。此外还有两例肝转移癌。HE染色结果证实类器官保留了患者肿瘤的病理学特征。通过对类器官和对应患者肿瘤标本的免疫荧光、免疫组化染色对比,证实肝癌类诊断标记物的一致性。团队选取99个位点,进行了组织和类器官的外显子、转录组测序,系统分析了组织与对应类器官株的基因组特征。从体细胞突变 (somatic mutations)、拷贝数变异 (copy number alterations, CNA) 等多维度验证了类器官生物库高度保留组织样本的基因组学特征。其中癌基因突变的一致率中位数为87.5%。团队建立的大规模肝癌组织和类器官队列也与以往肝癌研究一致,具有肝癌的高发突变。在转录组层面,类器官也与对应亲本组织也保持着高度的一致性。综上,多维度分析结果证实了本团队高质量类器官生物库的建立。
2)基于肝癌类器官生物库的瘤内异质性研究
基于外显子测序结果,团队对基因组异质性进一步研究,团队在部分患者的多区域类器官中,发现肿瘤体细胞突变、拷贝数变异在多区域类器官的显著不同。为了系统地研究基因组的瘤内异质性(intra-tumor heterogeneity, ITH),团队绘制了每个多区域取样患者的进化树,揭示了多点来源类器官的亚克隆特征。在临床预后的水平,mutation-ITH和CNA-ITH均与患者的临床预后相关,表现为mutation/CNA-ITH越高的患者,其临床预后越差(P<0.05)。
为了研究基因组、转录组异质性与药敏的异质性的规律,研究团队研究了原发性肝癌一线靶向药索拉非尼、仑伐替尼的靶基因在患者中的差异表达。发现部分患者中,索拉非尼、仑伐替尼的靶基因在多区域中有显著的表达差异,且不同位点间存在药敏异质性。提示ITH可能是导致患者内和患者间药敏差异的重要原因。
3)肝癌靶向药的大规模筛选
本团队选取临床上常用的肝癌一线药物索拉非尼、仑伐替尼,常用的二/三线药物瑞戈非尼、阿帕替尼、贝伐单抗,以及针对胆管癌FGFR2融合的药物培米替尼、胆管癌IDH1突变的药物艾伏尼布,对376例类器官进行大规模药物筛选,以探索肝癌药敏分子分型。研究团队结合客观缓解率 (objective response rate,ORR) 为分界,将这些位点划分为敏感和不敏感组,将所有位点均敏感的患者,判定为该药物敏感的患者。研究团队对比了类器官和临床的治疗效果,发现在14个有完整治疗随访的患者中,类器官的药敏与临床患者的药物治疗效果是一致的(P<0.05)。此外,团队也用动物模型验证了和类器官结果的一致性。为进一步通过类器官研究药敏分子分型奠定了临床基础。
4)通过机器学习模型解析肝癌临床靶向药的药敏分子分型
基因组异质性曾被报道与耐药相关,研究团队使用多区域类器官研究了基因组异质性与肝癌靶向药药敏的关联。与敏感组相比,在仑伐替尼耐药组中发现mutation-ITH和CNA-ITH水平显著升高,表明ITH与仑伐替尼耐药相关。提示基因组ITH在一定水平上,可以预测药物敏感度。然而,由于肝癌的靶向药是针对于患者的靶点表达,单独用基因组ITH评价药效存在局限性。因此,研究团队从类器官的转录组水平对药敏标记物做进一步分析。
在解析仑伐替尼药敏分子分型中,研究团队按收集标本的顺序,选取106个类器官作为训练集,用另外106个类器官作为验证集。在训练集中,研究团队发现有254个基因与仑伐替尼的药敏相关,其中JUN、TNFRSF8、IL1B为FDA批准的靶点。研究团队将这254个基因在肝细胞癌的TCGA-LIHC数据库中进行了很好的验证。研究团队通过机器学习模型,进一步揭示了13个仑伐替尼药敏标记物,包括JUN等。这些标记物在训练集和验证集中,AUC均在0.8以上。
沿用同样的方法,研究团队揭示了索拉非尼、瑞戈非尼、阿帕替尼的药敏分子分型。这些药敏分子分型可对临床治疗效果进行精准预测。
5)c-Jun作为关键靶点,介导仑伐替尼耐药
研究团队以肝癌一线药仑伐替尼为例,具体研究其关键耐药靶点,开发联合用药新方案。研究团队进行了蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络分析。发现JUN在该网络中处于核心地位。而且JUN是仑伐替尼的13个药敏标记物之一,也是FDA批准的药物的靶点。因此研究团队选JUN这一基因(编码c-Jun蛋白),做后续进一步分析。JUN的mRNA水平与仑伐替尼的IC50,呈显著正相关。免疫组化染色显示,在仑伐替尼的216个耐药区域中,c-Jun的蛋白水平也升高。且与癌旁组织相比,癌组织中c-Jun的含量也较高,提示c-Jun可以作为癌症治疗的靶点。研究团队进一步通过敲低和过表达c-Jun的方法,验证了仑伐替尼药物敏感度的变化。此外,团队引入三种c-Jun的抑制剂Veratramine, SR11302 和NY2267,与仑伐替尼联用,可增强仑伐替尼的药物敏感度,形成仑伐替尼联合用药新方案。在机制研究方面,团队揭示了JNK和Wnt/β-catenin作为c-Jun的上游,介导了仑伐替尼耐药的机制。
6)合成PKUF-01,提升肝癌治疗效果
基于团队发现的仑伐替尼和c-Jun抑制剂的协同用药效果,团队将仑伐替尼和c-Jun抑制剂藜芦胺连接,合成PKUF-01。团队在仑伐替尼耐药的类器官中,检测到PKUF-01对肿瘤更好的杀伤效果,并在裸鼠成瘤实验中进一步证实了PKUF-01的体内肿瘤杀伤效果。最后,团队揭示了PKUF-01的药敏分子分型,揭示了PKUF-01耐药类器官中,干性相关基因的高表达,提示PKUF-01的耐药可能与肿瘤干性相关。
综上,本研究基于肝癌类器官生物库,进一步解析了肝癌瘤内异质性,通过大规模靶向药筛选,揭示了靶向药药敏分子分型,阐明c-Jun介导仑伐替尼耐药机制,合成PKUF-01,为肝癌的精准诊疗提供了重要线索。
北京大学第一医院杨慧博士后、北京大学第一医院程景辉博士、河南省肿瘤医院庄昊副主任医师、北京大学第一医院徐红闯助理研究员和北京大学第一医院汪一诺博士研究生为该论文的并列第一作者。北京大学第一医院肿瘤转化研究中心张宁教授、北京大学肿瘤医院肿瘤生物信息中心吴健民教授、河南省肿瘤医院张建功教授为共同通讯作者。
原文链接:https://doi.org/10.1016/j.ccell.2024.03.004