2024年5月16日,北京大学-云南白药国际医学研究中心张宁教授、李航教授及薛瑞栋研究员团队合作在国际知名期刊Cancer Cell在线发表题为Integrative molecular and spatial analysis reveals evolutionary dynamics and tumor-immune interplay of in situ and invasive acral melanoma的封面论文,综合利用分子和空间多组学分析揭示了原位和侵袭性肢端黑色素瘤的克隆演化规律及肿瘤-免疫的相互作用机制。

肢端型黑色素瘤(acral melanoma, AM)是一种起源于手掌、足底和甲下等部位的恶性皮肤肿瘤,也是亚洲人群中最主要的黑色素瘤亚型。原位AM(AM in situ, AMis)突破基底膜进入真皮发展为侵袭性AM(invasive AM, iAM)是造成患者预后变差的重要里程碑事件。然而,目前关于AMis的研究仍然十分有限,AMis向iAM的演化过程尚不清楚,免疫微环境在这一过程中发挥的作用也不明确。
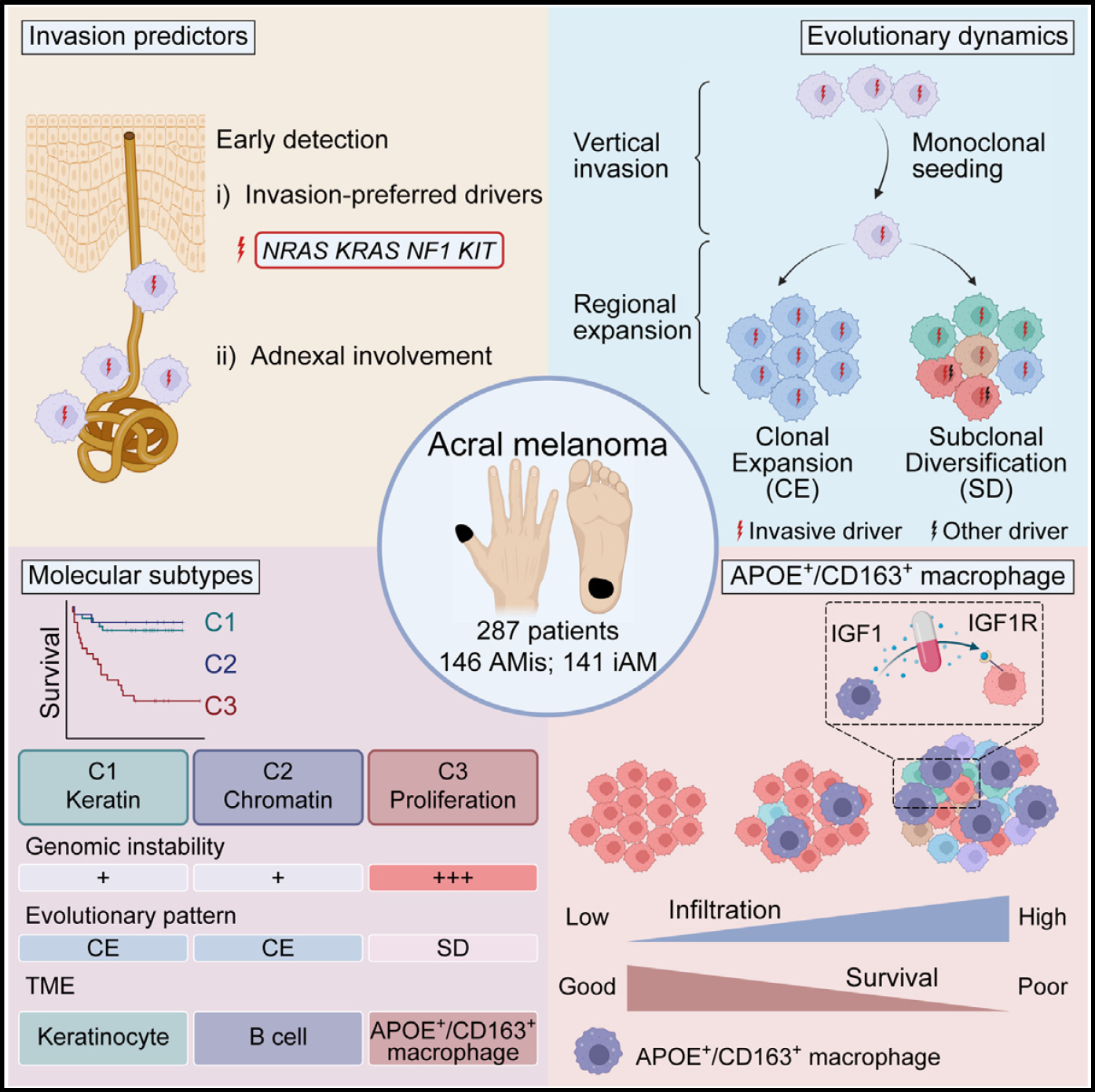
研究人员通过比较AMis和iAM的基因组和临床信息,发现驱动突变(NRAS, KRAS, NF1, KIT)在iAM中显著富集,并在体外实验中验证了这些驱动突变可以增强肢端型黑色素瘤的侵袭能力。还发现附属器受累也与AMis的驱动突变及侵袭能力密切相关。
基于显微切割的多区域基因组测序发现AMis在演化早期获得驱动突变并迅速穿过基底膜,以单克隆播散到真皮中。而当肿瘤在真皮中进行局部扩张时,不同患者中存在两种不同的扩张模式:(1)克隆扩张,即肿瘤细胞保持单一克隆结构进行均质扩张;(2)亚克隆分化,即肿瘤细胞在增殖过程中获得亚克隆,导致肿瘤异质性升高。
转录组测序、单细胞转录组测序、空间转录组和空间蛋白组学技术进一步探索了免疫微环境在肿瘤演化过程中的作用。通过建立分子分型,研究人员发现C3亚型是预后最差的iAM亚型。与非C3肿瘤相比,C3肿瘤主要经亚克隆分化而来,高表达EMT特征,且其免疫微环境中显著富集APOE+/CD163+巨噬细胞。实验结果表明,一方面,AM肿瘤细胞可以将单核细胞诱导为APOE+/CD163+巨噬细胞,这一表型由转录组测序、流式分析和多色免疫荧光共同确认。另一方面,APOE+/CD163+巨噬细胞可以通过分泌IGF1作用于肿瘤细胞表面的IGF1R,诱导肿瘤细胞发生EMT,而IGF1抑制剂、IGF1R抑制剂及敲除肿瘤的IGF1R均可以抑制这一过程。这些结果为开发新的AM治疗策略提供了思路。
最后,值得注意的是,上述分子分型是与肿瘤分期(T分期、AJCC分期)相互独立的预后因素,说明该分子分型反映了肿瘤的内在恶性特征。APOE和CD163染色可用于预测AM患者的分子分型及预后。
综上,本研究基于多组学测序,系统揭示了早期肢端型黑色素瘤的克隆演化规律,建立了肢端型黑色素瘤的分子分型,解析了肿瘤细胞-免疫细胞的空间互作关系,鉴定出新的早期诊断标志物(驱动突变和附属器受累)及晚期预后标志物(APOE和CD163),为肢端型黑色素瘤的早期诊断和精准诊疗提供了重要信息。
我中心张宁教授、李航教授和薛瑞栋研究员为共同通讯作者。我中心刘恒康博士后、北京大学第一医院皮肤性病科高嘉雯博士和北京大学第一医院肿瘤转化研究中心冯梅博士后为共同第一作者。本研究得到科技部重点研发计划、国家自然科学基金、北京市科技新星及北京大学临床医学+X青年专项等经费资助。

封面设计:
以葡萄藤根代表黑色素瘤AMis(水平生长期),在画面外向下攀爬代表AMis穿破基底膜进入到真皮,成为iAM(垂直生长期),离根源最近的iAM形态和色泽上更接近单克隆种子肿瘤细胞,随着藤蔓的攀援,出现不同程度的黑色成熟的葡萄(亚克隆多样化及恶性增加),鸟儿象征被招募的巨噬细胞并促进其播散转移。
原文链接:https://doi.org/10.1016/j.ccell.2024.04.012