免疫微环境的异质性是肿瘤耐药、复发和预后差的重要原因之一。近年来,免疫治疗及联合治疗给晚期肿瘤患者带来希望,系统探究肿瘤免疫微环境的异质性对于治疗选择、疗效预测、方案优化及开发新的免疫治疗靶点等有重要指导作用。北京大学第一医院张宁团队近年来一直聚焦于肝癌异质性探究,通过一系列前期工作揭示了肝癌的基因组、表型和单细胞拷贝数异质性和(Gastroenterology, 2016; Cancer Cell, 2019; Gastroenterology, 2022)。
然而,我们对肝癌免疫微环境的异质性仍缺乏系统深入的认知。以往研究主要基于病理分析或Bulk转录组测序,其结果无法准确解析其细胞组成且容易忽略含量较少的关键细胞亚群。单细胞测序技术的发展促进了肿瘤免疫领域的探索,目前多项研究已对肝癌进行了单细胞水平的探究。然而,这些研究大多关注特定类型细胞,其结果无法反映免疫微环境的全部特征。因此,亟需无偏差的、包含所有细胞亚型的研究策略以系统揭示肝癌免疫微环境的异质性。

2022年11月9日,北京大学第一医院肿瘤转化研究中心张宁团队与北京大学生物医学前沿创新中心(BIOPIC)张泽民团队、北京大学人民医院肝胆外科朱继业团队紧密合作,在Nature发表了题为“Liver tumor immune microenvironment subtypes and neutrophil heterogeneity”的研究论文。在该研究中,研究人员收集124个病例的160个样本和8只小鼠的29个新鲜组织样本,完成了共189个样本的无抗体富集的单细胞转录组测序(图1)。同时,研究人员对84个配套病例进行了外显子测序,并收集已发表的8个单细胞转录组测序数据集、453个组织转录组测序和10个空间转录组数据进行综合分析,并综合利用肿瘤细胞系构建In vitro培养体系,基于临床样本构建Ex vivo实验体系,基于小鼠肿瘤模型的In vivo实验体系进行综合验证。该研究首次在单细胞精度定义了肝癌的五种免疫微环境亚型(TIMELASER),探究了其细胞组成、空间分布、基因组特征和趋化因子受体-配体网络,首次全面揭示肿瘤相关中性粒细胞(TAN)的异质性,发现并验证CCL4+、PD-L1+ TAN两个关键亚群的促肿瘤机制,最终通过构建小鼠肝癌模型, 从In vitro, Ex vivo, In vivo三个层面,逐步深入地证明靶向肿瘤相关中性粒细胞有望形成新的肝癌免疫治疗方案,这些成果为肝癌的基础研究和临床诊疗提供了关键信息。
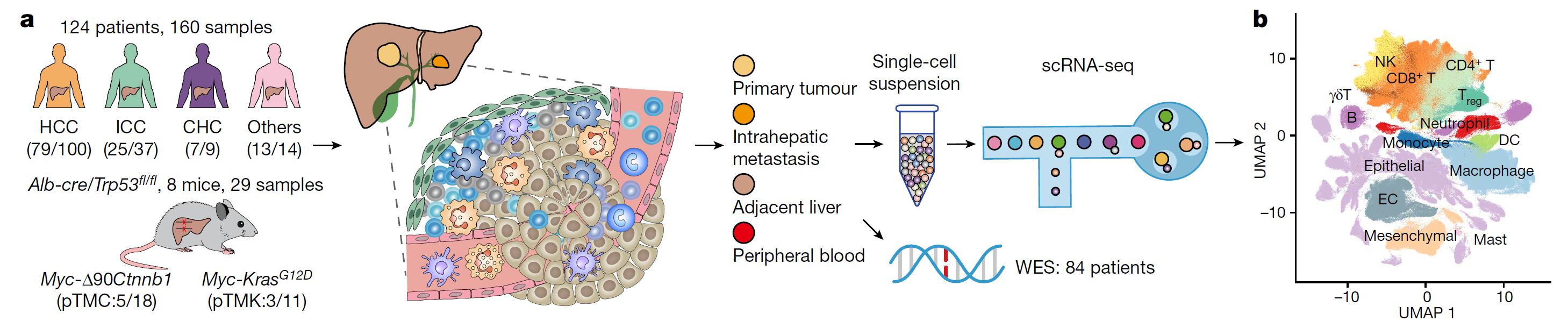
图1 本研究的实验设计
1)细胞模组分析揭示肝癌的五种免疫微环境亚型
首先,研究人员系统解析出肝癌免疫微环境的89个细胞亚群,这一发现远超过之前的研究,其中也首次发现了之前未报道的11种中性粒细胞亚群。研究人员发现这些细胞亚群在不同病例之间并不是平均分配。通过层次聚类分析,研究人员成功解析出5种不同的免疫微环境亚型,其中包含,①免疫激活型TIME-IA (Immune Activation);②髓系富集免疫抑制型TIME-ISM (Immune Suppressive Myeloid);③基质富集免疫抑制型TIME-ISS (Immune Suppressive Stromal);④免疫排斥型Immune Exclusion (TIME-IE);⑤免疫驻留型(Immune Residence),组合起来称之为TIMELASER分型系统(图2)。随后,研究人员对这五种免疫微环境亚型进行了多维度的分析,通过大规模转录组数据验证五种亚型的存在;通过空间转录组数据和CODEX多色免疫技术揭示五种亚型的细胞空间分布;通过受体配体分析发现每种亚型均存在不同的趋化因子受体-配体网络,提示了不同亚型的形成机制;联合外显子数据分析发现不同的亚型富集不同的驱动基因突变,如TP53, CTNNB1, KRAS 和IDH1,并发现不同的亚型富集不同的肿瘤细胞基因模组。这五种免疫微环境的发现为肿瘤免疫治疗提供了重要的参考信息。
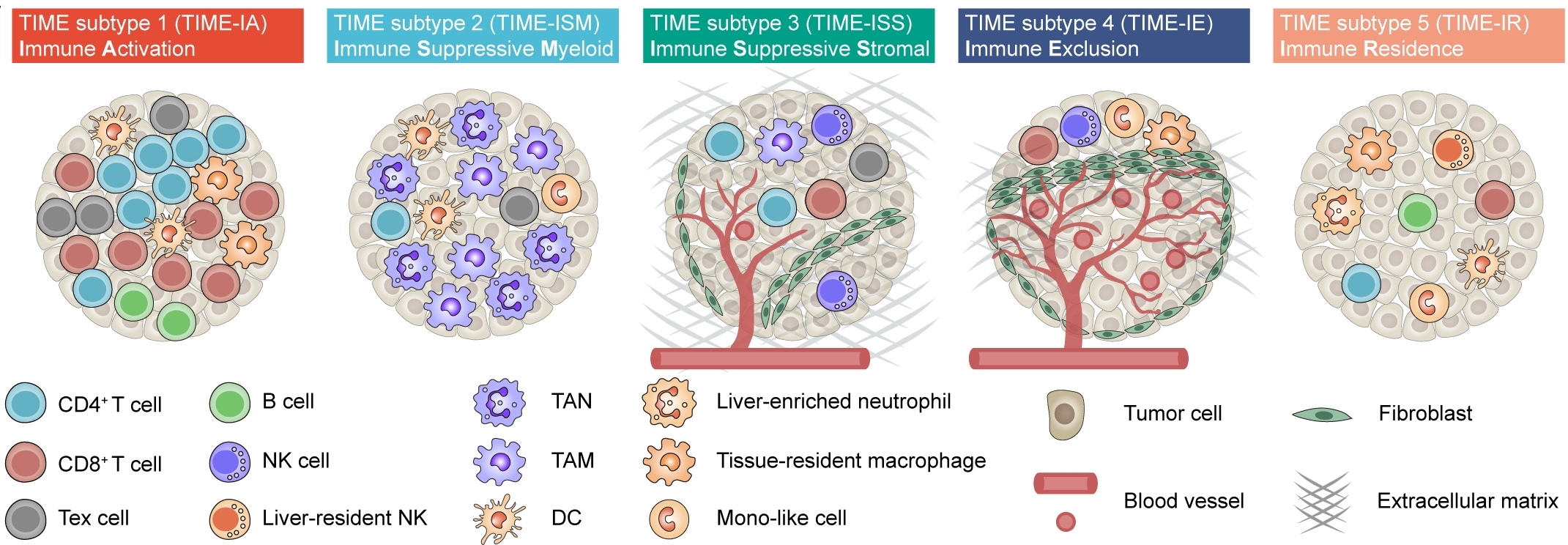
图2 肿瘤免疫微环境的5种亚型(TIMELASER)示意图
2)系统揭示11个中性粒细胞亚群、鉴定6群肿瘤相关中性粒细胞并通过实验证明CCL4+ TAN和PD-L1+ TAN的促肿瘤机制
中性粒细胞是一类非常脆弱的细胞,通常认为其在体内进入外周血后存活不超过一周,体外存活不超过24小时。因此,先前的肝癌单细胞研究均未捕获到这一群细胞。得益于快速实验流程和无抗体富集策略,本研究成功捕获到3万多个中性粒细胞。经过聚类分析,研究人员共发现11个中性粒细胞亚群,分别富集在外周血、癌旁和肿瘤组织中(图3),并成功鉴定出6群肿瘤相关中性粒细胞。随后,研究人员解析了这些中性粒细胞亚群的发育轨迹和关键转录因子,并发现两个中性粒细胞亚群CCL4+ TAN和PD-L1+ TAN可能通过不同的机制促进肿瘤生长。为了进一步验证这些发现,研究人员分别构建肝癌细胞系-中性粒细胞体外共培养体系(In vitro)和肝癌病人的中性粒细胞离体分析体系(Ex vivo),通过转录组测序、ATAC-seq和多色免疫荧光等实验验证了CCL4+ TAN通过招募肿瘤相关巨噬细胞促进肿瘤生长,而PD-L1+ TAN通过抑制CD8+ T细胞的杀伤功能促进肿瘤生长。
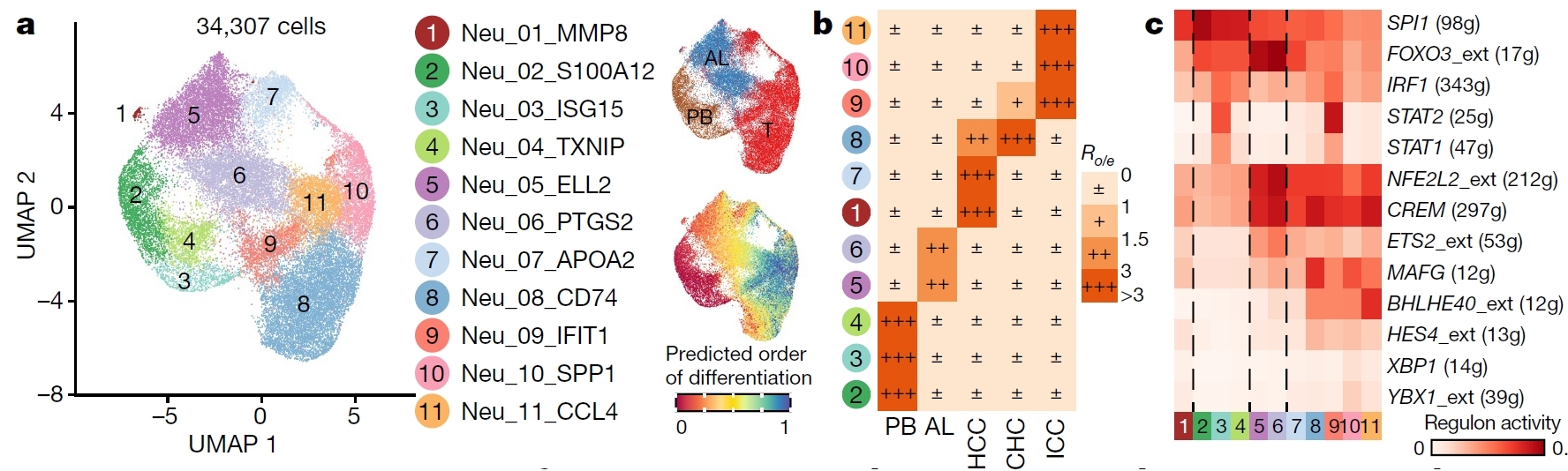
图3 中性粒细胞亚群的组织分布、发育轨迹、癌种富集和关键转录因子
3)构建小鼠肝癌模型、揭示其中性粒细胞亚群与人高度保守并证实去除中性粒细胞可以延缓肿瘤生长
为了进一步在体内探索中性粒细胞的促肿瘤机制,研究人员基于Alb-cre/Trp53fl/fl肝脏特异敲除小鼠和肝癌驱动突变构建两种小鼠肝癌自发肿瘤模型(Myc-∆90Ctnnb1, pTMC;Myc-KrasG12D, pTMK),并对其进行单细胞测序分析。研究人员发现小鼠的中性粒细胞亚群与人类高度保守,这一结果说明利用小鼠肝癌模型进行实验可为人类肝癌治疗提供重要参考信息。随后,研究人员利用Anti-Ly6G抗体在小鼠模型进行中性粒细胞去除实验,结果显示治疗后,小鼠肝癌生长得到了有效遏制(图4)。进一步,研究人员还揭示了治疗过程中小鼠骨髓、外周血、癌旁和肿瘤组织的中性粒细胞亚群的动态变化。这些结果提示开发基于中性粒细胞的免疫治疗靶点有望形成新的肝癌治疗策略。
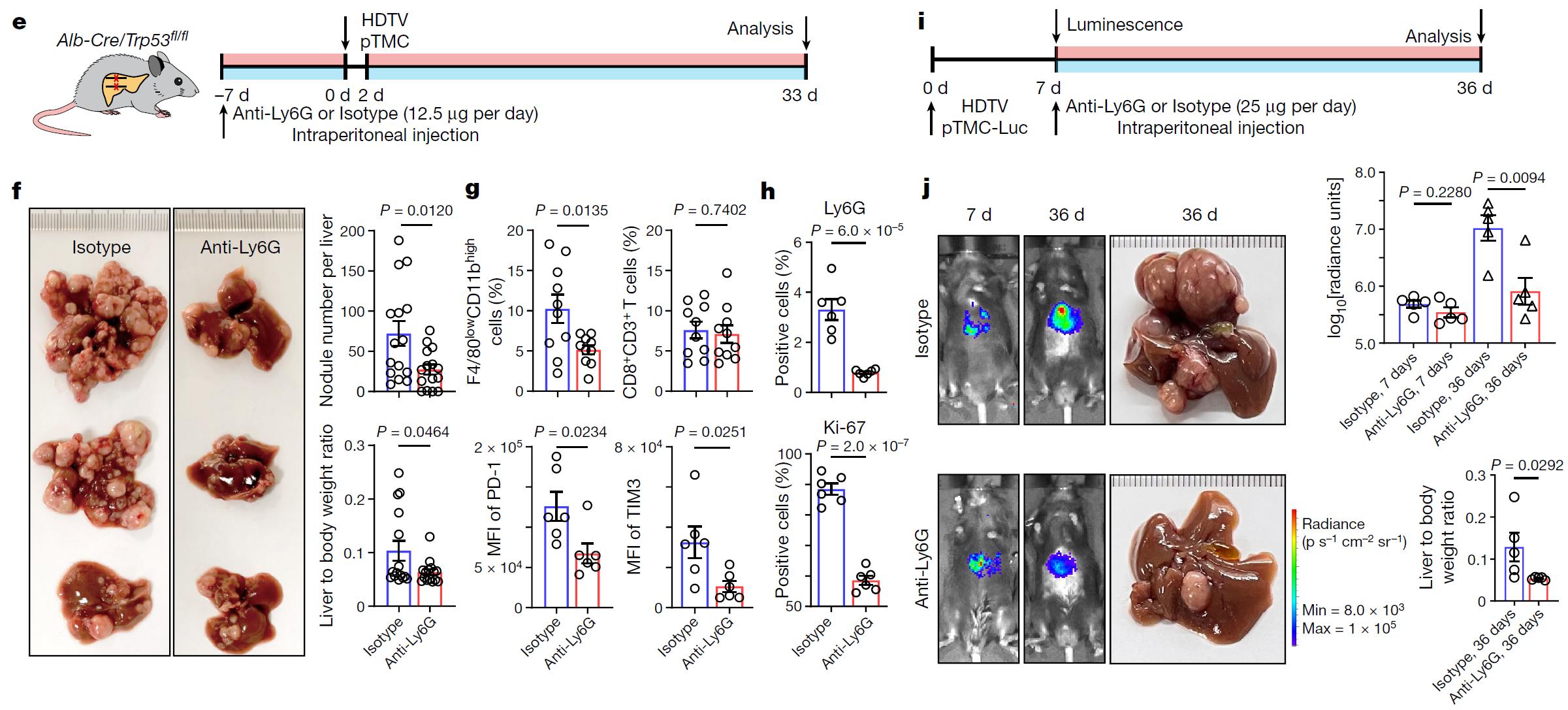
图4 Anti-Ly6G抗体去除中性粒细胞可以有效缓解小鼠肝癌生长
综上,本研究系统揭示了肝癌的免疫微环境亚型,并深入解析了肿瘤相关中性粒细胞的功能异质性,最终通过小鼠肝癌模型证明靶向肿瘤相关中性粒细胞有望形成新的肝癌免疫治疗策略。研究成果预示,针对肿瘤相关中性粒细胞的干预,有望大幅增加免疫检查点有效治疗的患者人群。这些成果为肝癌乃至实体瘤的基础研究和临床诊疗提供了关键信息。
北京大学第一医院薛瑞栋副研究员、北京大学BIOPIC张启明博士、北京大学第一医院博士研究生曹奇、北京大学第一医院孔瑞瑞副研究员和北京大学人民医院向骁博士是该论文的并列第一作者。北京大学第一医院肿瘤转化中心张宁教授、北京大学BIOPIC张泽民教授和北京大学人民医院朱继业教授为共同通讯作者。该研究得到国家自然基金、“十三五”国家科技重大专项、国家重点研发计划、基础科学中心等多项国家科学基金的支持和资助。